Wersja z 2024-09-29
Błędy w podręcznikach do chemii
wydawnictwa „Nowa Era”
Znalazł i omówił: Grzegorz Jagodziński
Zasadniczą rolą podręczników szkolnych jest dostarczanie młodym ludziom wiedzy o otaczającym świecie. Pełnią one rolę przewodników, nie powinny więc zawierać niedopowiedzeń, przekłamań i fałszywych informacji, które mogłyby wprowadzić czytelnika w błąd. Wydaje się, że jest więc oczywiste, że przed skierowaniem do druku powinny one przechodzić proces wyjątkowo dokładnego sprawdzania i detalicznej korekty.
Dodajmy, że w dzisiejszych czasach drukowane książki stały się znacznie mniej popularne niż były jeszcze niedawno, i dlatego wydawnictwom trudno jest sprzedać nowe tytuły. Nie dotyczy to jednak podręczników szkolnych, które póki co dostępne są jednak przede wszystkim w postaci drukowanej. Ich wydawanie, w przeciwieństwie do wydawania innych tytułów, pozwala czerpać stosunkowo niezłe profity, a to z kolei dostateczny powód, by starać się o ich wysoką jakość. Zatrudnienie korektorów i przeprowadzanie drobiazgowej analizy książki przed jej wydaniem po prostu się opłaca, bowiem na rynku podręczników panuje konkurencja, i największe zyski osiągną ci, których książki zostaną uznane za najlepsze.
Dlaczego zatem wydawnictwo „Nowa Era” dopuściło się karygodnych i żenujących błędów w wydawanych przez siebie podręcznikach? Trudno dociec przyczyny, warto jednak z tej sytuacji wyciągnąć wnioski.
Błędy, które zostaną poniżej omówione, pojawiły się w podręcznikach wydanych już kilka lat temu. Czy usunięto je w nowszych wydaniach? Warto to sprawdzić – nie zostały usunięte! Świadczy to jeszcze gorzej o podejściu Wydawnictwa do zadania, którym jest przecież pomoc w edukacji nowych pokoleń.
Błędy w podręczniku poziomu podstawowego chemii dla liceów i techników, część 1
Oto podręcznik, o którym będzie mowa:
Oto, co znajdujemy na stronie 16:
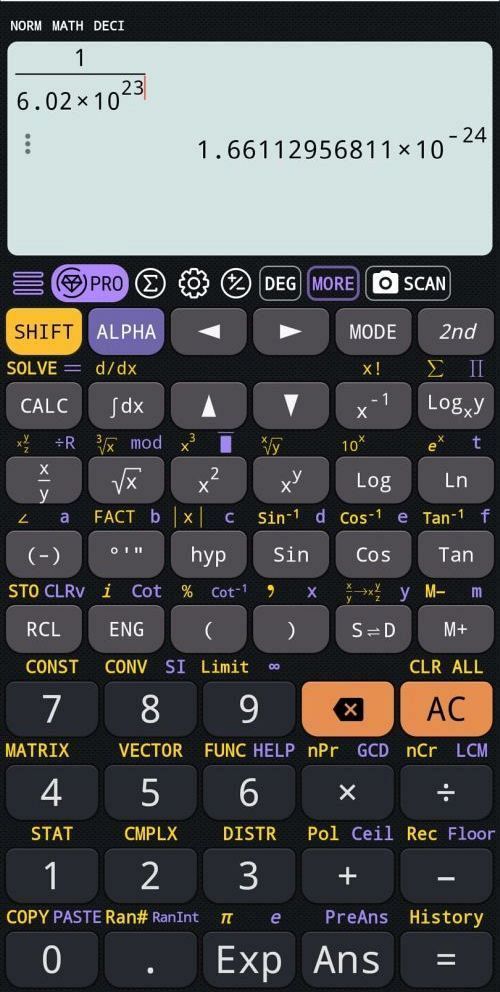
Niby wszystko tu jest w porządku, zwróćmy jednak uwagę na wartość liczbową u = `1.667 * 10^(−24)`. Czy na pewno jest to wartość poprawna?
Wartość ta jest odwrotnością liczby Avogadra. Sprawdźmy na kalkulatorze, czy rzeczywiście tyle wynosi:
Zamiast `1.667 * 10^(−24)` widzimy (w zaokrągleniu) `1.661 * 10^(−24)`. Niby wydawałoby się, że to niewielki błąd, bo dotyczy trzeciej cyfry po przecinku. A jednak… jest to skandal, bo przecież na takie błędy nie mogą sobie pozwolić autorzy podręczników szkolnych!
Na stronie 123 znajdziemy wartość poprawną, choć mniej dokładną: `0.166*10^(-23)`:
Przecież gdyby wartość `1.667 * 10^(−24)` była dokładna, wówczas byłoby `0.167*10^(-23)` (i byłoby źle).
Na stronie 126 mamy znowu błędną wartość `1.667 * 10^(−24)`. Zatem to nie chochlik drukarski!
Chyba ktoś miał zapisane w odręcznych notatkach `1.661` i omyłkowo wziął końcowe `1` za `7`. Ale dlaczego nikt tego nie sprawdził?
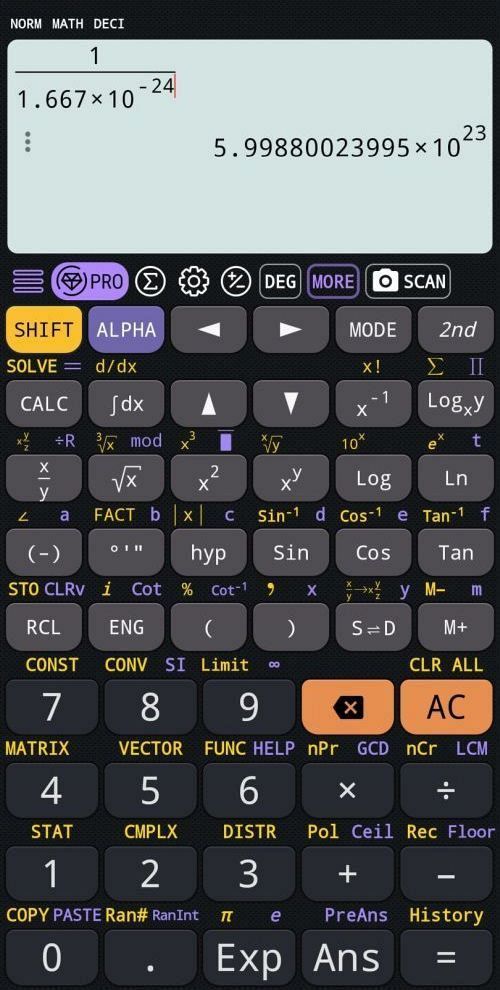
Gdyby jednak wartość `1.667 * 10^(−24)` była może nie dokładna, ale przynajmniej akceptowalna, ile wówczas wynosiłaby liczba Avogadra?
Otrzymana wartość `5.9988*10^23` optycznie znacznie różni się od prawdziwej wartości `6.02*10^23`.
W podręczniku dociekliwy czytelnik odkryje jeszcze jeden błąd. Oto na stronie 128 czytamy:
Definicja mola jest zgodna z formalną definicją przyjętą w świecie nauki i pod tym względem nie można jej nic zarzucić. Ale przecież podana w niej liczba `6.02*10^23` to nic innego jak zdefiniowana poniżej liczba Avogadra. Tyle tylko, że według tego, co napisano, mol odnosi się nie tylko do atomów, cząsteczek lub jonów, ale także do elektronów, protonów i neutronów. Tymczasem liczba Avogadra nie odnosi się do nich, co oczywiście jest nieprawdą.
Czy zatem elektrony nie są obiektami elementarnymi?
Na stronie 153 znów czytamy, że także mol odnosi się wyłącznie do atomów, cząsteczek lub jonów. A przecież poprzednio odnosił się także do elektronów, protonów i neutronów! Czyli tym razem nie można mówić o molu elektronów?
Należy ponadto postawić sobie pytanie, czy rzeczywiście mol jest jednostką, w której mierzy się tylko liczność obiektów elementarnych. Jeśli nawet, to czy dotyczy to wyłącznie atomów, cząsteczek, jonów, elektronów, protonów i neutronów? Czy wobec tego nie można mówić o molu mionów, o molu fotonów? A właściwie dlaczego nie można? Chemia jest nauką ścisłą, i jako taka nie może operować rozmytymi definicjami. Granice stosowalności tego czy innego pojęcia muszą być określone w sposób niebudzący wątpliwości.
Co to więc znaczy na przykład „obiekty elementarne”? Gdzie kończy się „elementarność”? Istnieje jakaś konkretna granica wielkości obiektów, których nie można już liczyć w molach i do których nie ma zastosowania liczba Avogadra?
Naprawdę istnieje taka granica? Zerknijmy wobec tego na stronę https://intro.chem.okstate.edu/ChemSource/Moles/mole15.htm i przeczytajmy w punkcie 2: „Astronomers estimate that there is a mole (`6.02 * 10^23`) of stars in the universe". Jak widać, na mole można też liczyć gwiazdy, a to raczej nie są obiekty elementarne.
Wystarczyło przecież napisać, że liczbę `6.02 * 10^23` nazywa się liczbą Avogadra i należy ją rozumieć tak samo, jak określenia „tuzin”, „tysiąc” czy „milion” (istnieją konkurencyjne podręczniki, których autorzy tak to właśnie przedstawiają). Mało to, pożyteczne (i robiące wrażenie na uczniach) byłoby zapisanie tej liczby słowami: sześćset dwa tryliardy. Jak każda liczba, jest pojęciem abstrakcyjnym, i można ją używać do liczenia czegokolwiek: atomów, elektronów, ziaren piasku lub gwiazd we wszechświecie. Próbka substancji zawierająca liczbę Avogadra atomów lub cząsteczek określana jest jako jeden mol tej substancji. Ale równie dobrze można mówić o molu elektronów, a nawet o molu gwiazd. Mol to po prostu ilość czegoś (nie tylko materii, bo przecież same elektrony to nie materia) złożonego z mniejszych, jednakowych obiektów, jeśli liczba tych obiektów jest równa liczbie Avogadra. Z dydaktycznego punktu widzenia takie sformułowanie jest o wiele bardziej zrozumiałe niż definiowanie liczby Avogadra tylko po to, by nie użyć tego pojęcia w definicji mola. Czyli właściwie po co?
Jak widać, autor nie potrafił ująć tego w ten sposób, i dlatego popełnił błąd, który właściwie można uznać za rażący. Związał mol z obiektami elementarnymi zupełnie niepotrzebnie, bo przecież (jak nietrudno sprawdzić) jest on w rzeczywistości używany także do liczenia obiektów, którym do elementarności bardzo daleko.
Błędy w podręczniku poziomu rozszerzonego chemii dla liceów i techników, część 2
Oto podręcznik, o którym będzie mowa:
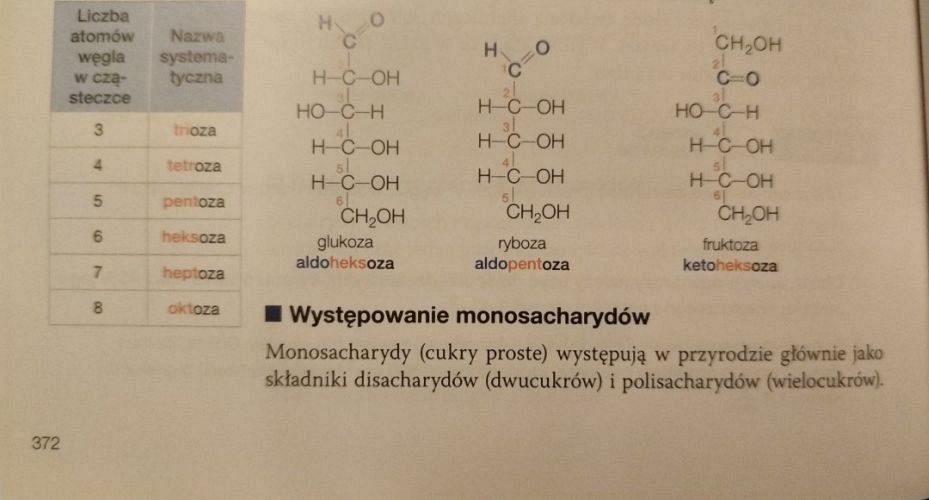
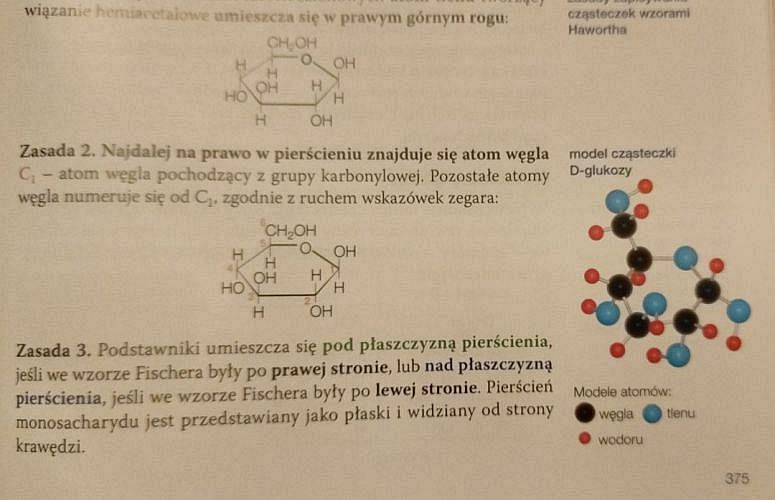
Na stronie 372 znajdziemy poprawne wzory niektórych sacharydów, w tym glukozy. Zwróćmy uwagę na konfiguracje podstawników przy trzecim i czwartym atomie węgla (położenie grup –OH jest przeciwne):
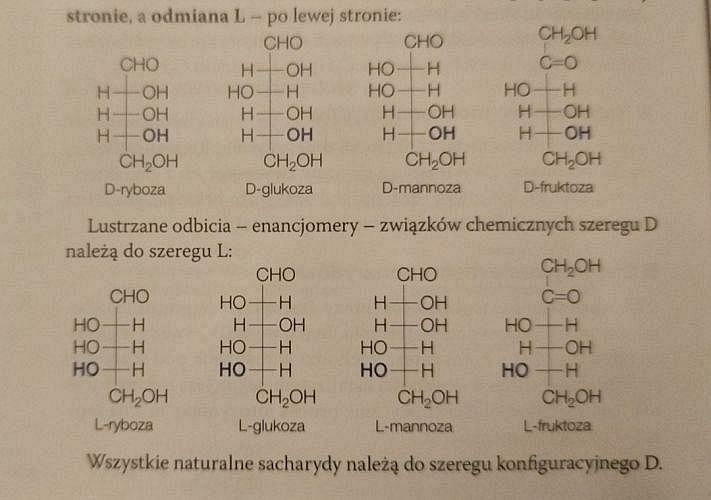
Na stronie 374 znajdziemy ponownie poprawne wzory D-sacharydów:
Ale czy wzory L-sacharydów również są poprawne?
Przecież każdy z wzorów L-sacharydów powinien być lustrzanym odbiciem wzoru D-sacharydu. Spójrzmy na wzór podpisany jako L-fruktoza. Czy jest odbiciem wzoru D-fruktozy?
Nie! Konfiguracja przy atomach węgla nr 3 jest odwrotna niż ta, która występuje w prawdziwej L-fruktozie. W rzeczywistości wzór przedstawia L-sorbozę, a nie L-fruktozę.
To nie koniec błędów w tym podręczniku.
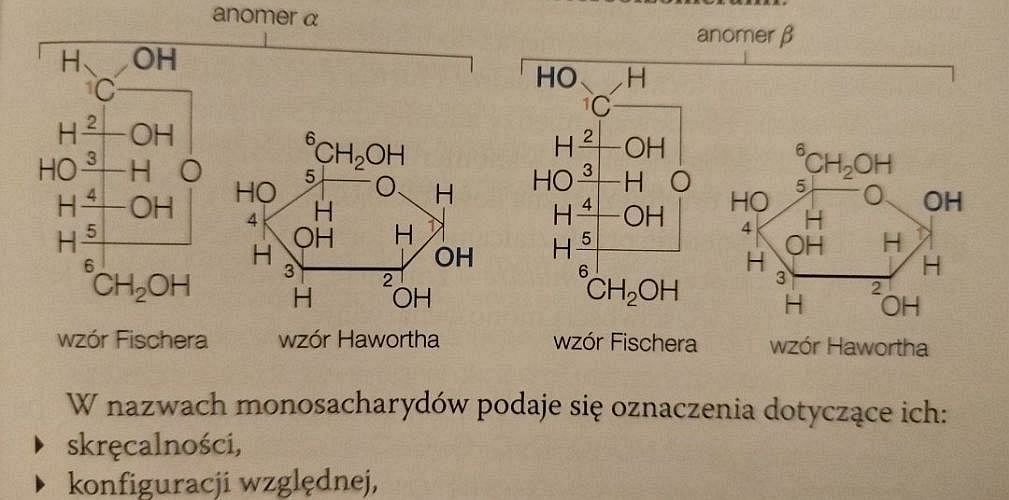
Wzory D-glukozy podane na stronie 375 są poprawne. A wzory na stronie 377?
A na stronie 377 umieszczono poprawne wzory Fischera, ale błędne wzory Hawortha. Przecież konfiguracja podstawników przy atomie węgla numer 4 jest taka sama, jak przy atomie węgla numer 3!
Podane tu wzory Hawortha przedstawiają w rzeczywistości D-galaktozę.
Nawiasem mówiąc, w całej książce nigdzie nie podano poprawnego i poprawnie podpisanego wzoru galaktozy.
Tutaj znów autor wzoru delikatnie mówiąc rozmija się z prawdą, co w podręczniku szkolnym jest rzeczą skandaliczną. Wzory pierścieniowe zupełnie nie pokrywają się z łańcuchowymi, bowiem łańcuchowy rzeczywiście przedstawia glukozę, natomiast oba pierścieniowe – galaktozę.
Szanowny autor mógł przecież porównać spłodzone przez siebie wzory z tymi, które spłodził wcześniej, i które są poprawne. Dlaczego tego nie zrobił? Może zabrakło mu kompetencji? Przecież prawdziwy chemik nigdy nie popełniłby takich rażących błędów!
Kto więc w ogóle rysował te wzory?
O proszę, a tu jakoś udało się narysować wzór poprawny!
Należałoby tu jeszcze wspomnieć chyba o tym, że tak zwana forma pierścieniowa jest w zasadzie odrębnym izomerem (choć z uwagi na jej nietrwałość nie używa się tego określenia) i dlatego ma własną nazwę: D-glukopiranoza.
Mówimy przecież o podręczniku chemii rozszerzonej! Nazwy typu glukopiranoza czy fruktofuranoza powinny się w nim znaleźć przynajmniej jako informacje uzupełniające.
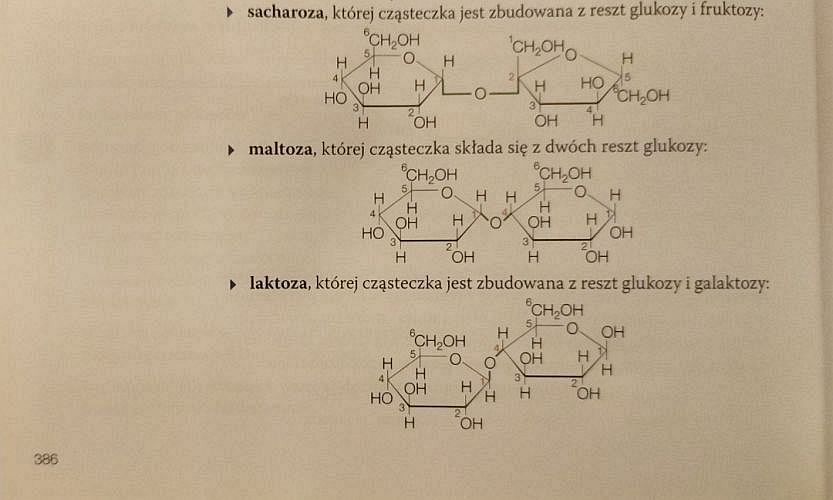
Tutaj wzory sacharozy i maltozy narysowano poprawnie. Nawet jednak przeciętnie uzdolniony uczeń zapyta, który z pierścieni we wzorze laktozy pochodzi od glukozy, a który od galaktozy. Bo przecież są one identyczne (czyli kolejny wzór narysowany jest błędnie).
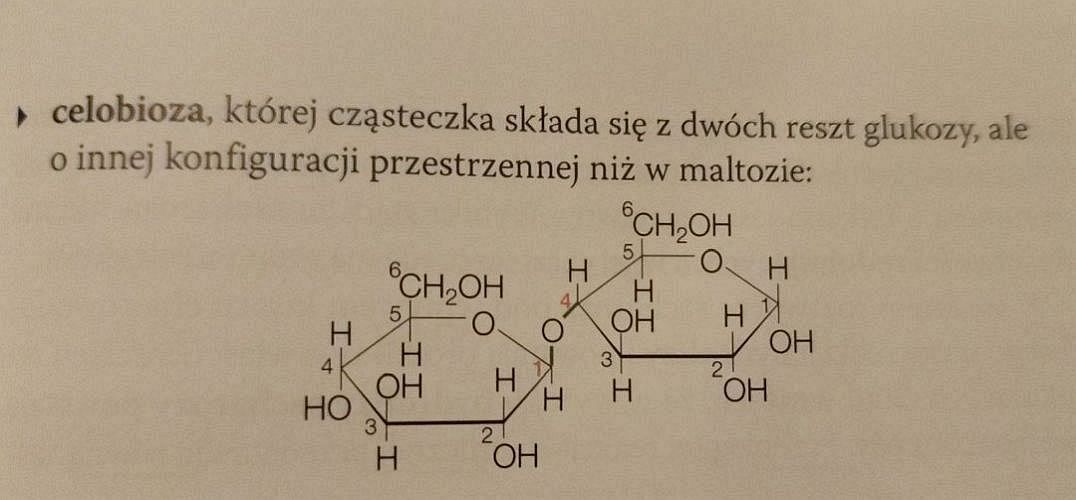
Wzór celobiozy (na następnej stronie) jest poprawny. Ale czym się różni od tego, który niby przedstawia laktozę? Konfiguracją podstawników przy atomie węgla numer 1 w prawym pierścieniu? To oczywiście za mało, by mówić o odrębnym związku, bo to atom anomeryczny. Różnica konfiguracji przy tym atomie nie tworzy w zasadzie nowego związku. Oba rysunki: poprawny celobiozy i błędny laktozy przedstawiają po prostu odmiany α i β celobiozy.
Aby wzór laktozy był poprawny, grupa -OH skrajnie po lewej, przy czwartym atomie węgla lewego pierścienia, powinna być skierowana ku górze, a nie w dół. To właśnie różni galaktozę od glukozy, a nie konfiguracja przy atomie anomerycznym.
Przy okazji, popełniono jeszcze jeden rażący błąd (kto to w ogóle pisał, jakiś człowiek z ulicy?). Laktoza nie składa się z glukozy i galaktozy, ale z galaktozy i glukozy. Kolejność jest istotna, bo informuje, który pierścień tworzy wiązanie glikozydowe w pozycji 1. I tym pierścieniem jest lewy pierścień, czyli pierścień galaktozy, a nie glukozy.
Wyjątkowo niekompetentnemu autorowi radziłbym na drugi raz skonsultować jego pogląd z niesłusznie pogardzaną Wikipedią. Czytamy w niej: „Laktoza, cukier mleczny (łac. lac ‘mleko’), C12H22O11 – organiczny związek chemiczny z grupy węglowodanów, dwucukier zbudowany z D-galaktozy i D-glukozy, połączonych wiązaniem β-1,4-glikozydowym. Występuje w mleku wszystkich ssaków w ilości 2–8%. Jest mniej słodka niż glukoza i sacharoza”.
Przy omawianiu laktozy na lekcji chemii nauczyciel powinien wspomnieć o tym, że w węglowodanie tym występuje wiązanie β-1,4-glikozydowe, i właśnie dlatego nie ulega ona trawieniu w obecności zwykłych hydrolaz (amylaz) przewodu pokarmowego, te bowiem mogą jedynie hydrolizować wiązania α-glikozydowe. Do hydrolizy laktozy potrzebny jest osobny enzym, laktaza. Jej obecność u dorosłych ludzi jest wynikiem pojawienia się i rozprzestrzenienia się mutacji, do dziś wielu ludzi nie toleruje obecności laktozy w przyjmowanym pokarmie. Przecież tego typu informacje, odwołujące się do związków przyczynowo-skutkowych i do życia codziennego zawsze powinny mieć pierwszeństwo w systemie edukacyjnym nad suchymi, encyklopedycznymi faktami. Wie o tym każdy dobry nauczyciel, ale najwyraźniej nie autor podręcznika odpowiedzialny za rozdział opisujący sacharydy.
Ba! Można (i należy) wywód ten rozwinąć. Dlaczego właściwie mleko ssaków zawiera laktozę, a nie np. sacharozę czy glukozę? Niby jest to problem biologiczny, a nie chemiczny, ale wiedza jest jedna i takie ścisłe rozgraniczanie jej elementów jest całkowicie sprzeczne z zasadami dydaktyki. Należało więc nadmienić, że pojawienie się laktozy w mleku ssaków wraz z zanikiem wytwarzania laktazy po osiągnięciu pewnego wieku wymusza na młodych osobnikach poszukiwanie innych źródeł pokarmu niż matczyne mleko. A to z kolei umożliwia wydanie na świat i wykarmienie nowego potomstwa. Ten piękny przykład wnioskowania z wiedzy chemicznej oczywiście pominięto całkowicie, co mówiąc szczerze rzutuje bardzo negatywnie na poziom podręcznika.
Poza tym należało wspomnieć, że wiązania β-glikozydowe stanowią poważne wyzwanie dla organizmów żywych. Laktaza jest w stanie katalizować hydrolizę laktozy, ale nie celobiozy. Najwyraźniej przeszkadza w tym jedyna różnica w budowie chemicznej obu tych cukrów, mianowicie konfiguracja podstawników przy 4. atomie węgla lewego pierścienia, decydująca o różnicy między galaktozą a glukozą (której autor nie zauważa, albo o której nie ma pojęcia – tego przynajmniej dowodzą błędne wzory, które zamieścił w podręczniku). Enzym umożliwiający hydrolizę wiązań glikozydowych między dwiema podjednostkami glukozy jest rzadkością w świecie istot żywych. Człowiek w zasadzie nie ma w przewodzie pokarmowych symbiontów, które byłyby w stanie zhydrolizować wiązania β-glikozydowe między podjednostkami glukozy, stąd dla nas tego typu związki nie są źródłem pokarmu (choć spełniają inne pożyteczne funkcje). Natomiast laktoza, mimo obecności wiązania β-glikozydowego, jest przyswajalna, o ile dostępny jest odpowiedni enzym, zdolny ją zhydrolizować.
Podsumowując, należy wyrazić ubolewanie nad tym, że cenione wydawnictwo zatrudniło do napisania podręczników chemii osoby niekompetentne. Nie chodzi nawet o to, że autorzy ci ewidentnie nie mają pojęcia o tym, jak przekazywać wiedzę w sposób ciekawy, nieencyklopedyczny, nawiązujący do otaczającego świata, i dlatego pomijają milczeniem ważne wnioski wypływające z opisywanych faktów chemicznych. Bardziej żałosne jest to, że przepisują ze swoich ręcznych notatek cyfrę `1` jako `7` i nawet nie fatygują się, by to sprawdzić (co zajmuje dosłownie kilka sekund). A jeszcze bardziej żałosne jest to, że albo podchodzą do rysowania wzorów sacharydów w sposób niezwykle swobodny, nie kontrolując tego, co robią, albo rzeczywiście brak im kompetencji, by pisać podręczniki szkolne.
Jak to w ogóle możliwe, że takich ludzi zatrudniono do tak poważnych zadań? I dlaczego Wydawnictwo nie zatrudniło kompetentnego korektora, który sprawdziłby to, co popełnił roztargniony (?) autor?
Czy naprawdę w tym kraju nie ma ludzi, którzy byliby w stanie sprawdzić taki podręcznik przed oddaniem go do druku? Jeśli naprawdę na tym polega problem, z chęcią polecę w przyszłości własne usługi.
Zobacz też: